Физические свойства алюминия и меди: теплопроводимость

Тяжело представить современный мир без такового сплава, как алюминий. Благодаря таковым своим качествам, как лёгкость, стойкость к коррозии, крепкость и способности заходить в соединения с иными сплавами алюминий стал важным конструкционным материалом XX и XXI века.
Этот серебристый сплав применяется в почти всех отраслях индустрии: в автомобилестроении, самолётостроении, в строительстве и непременно, в электроэнергетике. Алюминий является 13 элементом в повторяющейся таблице Дмитрия Ивановича Менделеева. Сейчас подсчитано, что на него приходится приблизительно 8% от всей массы твёрдой земной коры и он является 3 хим элементом по распространённости на планетке Земля, уступая пространство лишь кислороду и кремнию.
История открытия

Но потому что алюминий владеет высочайшей хим активностью, то в чистом виде он фактически не встречается в природе, потому в отличие от почти всех остальных металлов о нём сделалось понятно лишь сначала XIX века, когда алюминий был формально получен.
В 1824 году датский физик в процессе электролиза в первый раз получил алюминий. Хотя сплав и содержал примеси ртути и калия, этот вариант является первым доказанным случаем получения алюминия в лабораторных критериях.
Имя учёного, привёдшего к революционному способу, было Ханс Кристиан Эрстед. Но пригодилось ещё практически полста лет, чтоб создать технологии для получения его в промышленном производстве. Больше всего природный алюминий встречается в составе минералов квасцов. Конкретно благодаря этому минералу алюминий и получил своё заглавие, которое на латыни звучит Alumen.
Дюралевая руда
В современном мире при производстве алюминия используют обширно распространённую в природе дюралевую руду — бокситы. Бокситы являются глинистой горной породой, в состав которой входят различные модификации гидроксида с таковыми примесями, как хром, кремний, титан, сера, ванадий, карбонатные соли магния, кальций, железо.
В бокситах можно повстречать практически половину таблицы хим частей Менделеева. Ценность данной руды заключается в том, что кроме одной тонны алюминия, добытой из четырёх тонн бокситов, ценность для индустрии имеют и примеси. Из бокситов в процессе переработки получают белоснежный порошок — оксид алюминия (Al2O3), который ещё имеет заглавие «глинозём». Конкретно из глинозёма путём электролиза на современных предприятиях создают сплав.
Роль электроэнергетики в производстве

При производстве алюминия затрачивается грандиозное количество электроэнергии. Для того чтоб получить одну тонну сплава, энергии тратится столько, что её хватило бы на нужды 100-квартирного дома в протяжении целого месяца. А конкретно 15 МВт*ч. Потому большая часть дюралевых заводов размещаются неподалеку от гидроэлектростанций, атомных электростанций либо имеют собственные термо электростанции, также развитую структуру электроэнергетических систем и сетей.
Свойства алюминия
В алюминии заложено редчайшее сочетание таковых параметров, как:
- маленький вес;
- пластика, электропроводность;
- возможность создавать сплавы с иными сплавами.
Поверхность алюминия постоянно покрыта тонкой оксидной плёнкой, которая является весьма крепкой и не дозволяет алюминию подвергаться коррозии. Этот материал и в жарком, и в прохладном состоянии просто поддаётся обработке давлением. Такие способы обработки, как прокатка, штамповка, волочение нередко выполняются на предприятии при производстве тех либо других деталей.
Ещё одна ценность алюминия состоит в том, что он не токсичен, не подвержен горению и не нуждается в доборной расцветке: это делает его применение в авто- и авиастроении неподменным элементом. Ковкость алюминия поражает: из него удалось сделать лист и весьма узкую проволоку шириной всего в 4 микрона, а толщины фольги — достигнуть втрое тоньше волоса человека.
Благодаря способности алюминия создавать соединения с большенный группой хим частей возникла большая группа сплавов. К примеру, сочетание алюминия и цинка употребляется в разработке корпусов разных видов планшетов и телефонов, алюминий в сочетании магния и кремния употребляется при производстве разных типов движков, в составе частей шасси и различных движков. Разные сплавы используются и в электроэнергетике.
Современная наука продолжает учить и изобретать новые типы дюралевых сплавов. Сейчас не существует ни одной отрасли индустрии, где бы не употреблялся алюминий. Можно с уверенностью сказать, что такие виды индустрии, как авиационная, галлактическая, энергетическая, авто, пищевая, электрическая получили своё современное развитие благодаря алюминию и его сплавам.
Недозволено не упомянуть о таком принципиальном свойстве, как теплопроводимость. Ведь конкретно это свойство сплава требуется при производстве систем отопления, электропродукции, в авто- и авиастроении, при изготовлении тормозных систем и тому схожих. Теплоёмкость — это процесс переноса термический энергии в физических телах либо их частичках от жарких объектов к прохладным на базе закона Фурье. Соперником алюминия в данной области является медь.

Так какой сплав имеет огромную теплопроводимость? Это не совершенно конкретный вопросец. Понятно, что алюминий по теплопроводимости уступает меди при средних температурах, но когда входит речь о низких температурах, а конкретно при 50 К, тогда теплопроводимость алюминия существенно растет, в то время как у меди теплопроводимость становится ниже. Температура плавления алюминия составляет 933,61 К, это приблизительно 660 °C, в этот момент свойства Al, такие как теплопроводимость и плотность, уменьшаются.
Плотность серебристого сплава определяется его температурой и зависит от его состояния. Так, при температуре в 27 °C, плотность алюминия соответственно равна 2697 кг/м 3 , а при температуре плавления, равной 660 °C, его плотность приравнивается 2368 кг/м 3 . Понижение плотности метала зависимо от температуры обуславливается его расширением при конкретном нагревании.
Таблицы параметров алюминия и меди
Дальше, разглядим таблицы физических параметров и теплопроводимости алюминия и меди при согласовании различных температур.
- плотность Cu и Al, кг/м 3 ;
- удельная теплоёмкость Cu и Al, Дж/(кг·K);
- температуропроводность Cu и Al, м 2 /с;
- теплопроводимость Cu и Al, Вт/(м·K);
- удельное электронное сопротивление Cu и Al, Ом·м;
- функция Лоренца Cu и Al;
Таблица физических параметров алюминия
| T, K | кг/м 3 | Дж/(кг·K) | м 2 /с | Вт/(м·K) | Ом·м | L/L0 |
| 50 | — | — | 358 | 1350 | 0.0478/0.0476 | — |
| 100 | 2.725 | 483.6 | 228 | 300.4/302 | 0.442/0.440 | — |
| 200 | 2.715 | 800.2 | 109 | 236.8/237 | 1.587/1.584 | 0.78 |
| 300 | 2.697 | 903.7 | 93.8 | 235.9/237 | 2.733/2.733 | 0.88 |
| 400 | 2.675 | 951.3 | 93.6 | 238.8/240 | 3.866/3.875 | 0.94 |
| 500 | 2.665 | 991.8 | 88.8 | 234.7/236 | 4.995/5.020 | 0.96 |
| 600 | 2.652 | 1036.7 | 83.7 | 230.1/230 | 6.130/6.122 | 0.95 |
| 700 | 2.626 | 1090.2 | 78.4 | 224.4/225 | 7.350/7.322 | 0.96 |
| 800 | 2.595 | 1153.8 | 73.6 | 220.4/218 | 8.700/8.614 | 0.97 |
| 900 | 2.560 | 1228.2 | 69.2 | 217.6/210 | 10.18/10.005 | 0.99 |
| 933.61s | 2.550 | 1255.8 | 68.0 | 217.7/208 | 10.74/10.565 | 1 |
| 933.61l | 2.368 | 1176.7 | 35.2 | 98.1 | — 24.77 | 1.06 |
| 1000 | 2.350 | 1176.7 | 36.4 | 100.6 | — 25.88 | 1.06 |
| 1200 | 2.290 | 1176.7 | 39.5 | 106.4 | — 28.95 | 1.04 |
| 1400 | — | 1176.7 | 42.4 | — | — 31.77 | — |
| 1600 | — | 1176.7 | 44.8 | — | — 34.40 | — |
| 1800 | — | 1176.7 | 46.8 | — | — 36.93 | — |
Таблица физических параметров меди
| T, K | кг/м 3 | Дж/(кг·K) | м 2 /с | Вт/(м·K) | Ом·м | L/L0 |
| 50 | — | — | — | 1250 | 0.0518 | — |
| 100 | — | — | — | 482 | 0.348 | — |
| 200 | — | — | 130 | 413 | 1.048 | — |
| 300 | 8.933 | 385.0 | 117 | 401.9/401 | 1.725 | 0.945 |
| 400 | 8.870 | 3.97.7 | 111 | 391.5/393 | 2.402 | 0.961 |
| 500 | 8.628 | 408.0 | 107 | 385.4/386 | 3.090 | 0.976 |
| 600 | 8.779 | 416.9 | 103 | 376.9/379 | 3.792 | 0.976 |
| 700 | 8.726 | 425.1 | 99.7 | 369.7/373 | 4.514 | 0.976 |
| 800 | 8.656 | 432.9 | 96.3 | 360.8/366 | 5.262 | 0.973 |
| 900 | 8.622 | 441.7 | 93.3 | 355.3/359 | 6.041 | 0.979 |
| 1000 | 8.567 | 451.4 | 90.3 | 349.2/352 | 6.868 | 0.979 |
| 1100 | 8.509 | 464.3 | 85.5 | 337.6/346 | 7.717 | 0.972 |
| 1200 | 8.451 | 480.8 | 80.6 | 327.5/339 | 8.626 | 0.970 |
| 1300 | 8.394 | 506.5 | 75.8 | 322.1/332 | 9.592 | 0.972 |
| 1357.6s | 8.361 | 525.2 | 72.3 | 317 | 10.171 | 0.972 |
| 1357.6l | 8.00 | 513.9 | 41.2 | 175 | 21.01 | 1.08 |
| 1400 | 7.98 | 513.9 | 42.7 | 175 | 21.43 | 1.08 |
Из всего перечисленного выше ясно видно, что алюминий является одним из приоритетных металлов в индустрии, но у него есть ещё одно свойство: этот сплав и его сплавы можно переплавлять, причём не один раз, без утрат его черт. Кроме остального, это экономически прибыльнее, чем добыча из руды. Так, на одной электроэнергии экономия превосходит 14 кВт/ч. По подсчётам, 75% добытого за всё время алюминия и его сплавов употребляются по истинное время.
Алюминий

Алюминий – это пластичный и лёгкий сплав белоснежного цвета, покрытый серебристой матовой оксидной плёнкой. В повторяющейся системе Д. И. Менделеева этот хим элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Приобрести алюминий вы сможете на нашем веб-сайте.
История открытия
В 16 веке известный Парацельс сделал 1-ый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неведомого тогда сплава. В 18 веке к этому тесту возвратился германский химик Андреас Маргграф. Оксид алюминия он именовал «alumina», что на латинском языке значит «вяжущий». На тот момент сплав не воспользовался популярностью, потому что не был найден в чистом виде.
Долгие годы выделить незапятнанный алюминий пробовали английские, датские и германские учёные. В 1855 году в Париже на Глобальной выставке сплав алюминий произвёл фурор. Из него делали лишь предметы роскоши и ювелирные декорации, потому что сплав был довольно драгоценным. В конце 19 века возник наиболее современный и дешёвый способ получения алюминия. В 1911 году в Дюрене выпустили первую партию дюралюминия, нареченного в честь городка. В 1919 из этого материала был сотворен 1-ый самолёт.
Физические свойства
Сплав алюминий характеризуется высочайшей электропроводностью, теплопроводимостью, стойкостью к коррозии и морозу, пластичностью. Он отлично поддаётся штамповке, ковке, волочению, прокатке. Алюминий отлично сваривается разными видами сварки. Принципиальным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С.
Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые усугубляют свойства незапятнанного сплава. Главные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени чистки различают алюминий высочайшей и технической чистоты. Практическое различие заключается в отличии коррозионной стойкости к неким средам. Чем чище сплав, тем он дороже. Технический алюминий употребляется для производства сплавов, проката и кабельно-проводниковой продукции. Сплав высочайшей чистоты используют в особых целях.
По показателю электропроводности алюминий уступает лишь золоту, серебру и меди. А сочетание малой плотности и высочайшей электропроводности дозволяет соперничать в сфере кабельно-проводниковой продукции с медью. Долгий отжиг улучшает электропроводность, а нагартовка усугубляет.
Теплопроводимость алюминия увеличивается с повышением чистоты сплава. Примеси марганца, магния и меди понижают это свойство. По показателю теплопроводимости алюминий проигрывает лишь меди и серебру. Благодаря этому свойству сплав применяется в теплообменниках и радиаторах остывания.
Алюминий владеет высочайшей удельной теплоёмкостью и теплотой плавления. Эти характеристики существенно больше, чем у большинства металлов. Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Сплав отлично полируется и анодируется.
Алюминий имеет огромное сродство к кислороду и покрывается на воздухе узкой крепкой плёнкой оксида алюминия. Эта плёнка защищает сплав от следующего окисления и обеспечивает его отличные противокоррозионные свойства. Алюминий владеет стойкостью к атмосферной коррозии, морской и пресной воде, фактически не вступает во взаимодействия с органическими кислотами, концентрированной либо разбавленной азотной кислотой.
Хим свойства
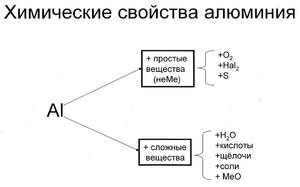
Алюминий — это довольно активный амфотерный сплав. При обыденных критериях крепкая оксидная плёнка описывает его стойкость. Если повредить оксидную плёнку, алюминий выступает как активный металл-восстановитель. В мелкораздробленном состоянии и при высочайшей температуре сплав ведет взаимодействие с кислородом. При нагревании происходят реакции с сероватой, фосфором, азотом, углеродом, йодом. При обыденных критериях сплав ведет взаимодействие с хлором и бромом. С водородом реакции не происходит. С сплавами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Просто протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий просто реагирует со щелочами. Практическое применение в металлургии отыскало свойство восстанавливать сплавы из оксидов и солей – реакции алюминотермии.
Получение
Алюминий находится на первом месте посреди металлов и на 3-ем посреди всех частей по распространённости в земной коре. Примерно 8% массы земной коры составляет конкретно этот сплав. Алюминий содержится в тканях звериных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов. Каменная оболочка земли, находящаяся в базе материков, формируется конкретно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в итоге вулканических действий в соответственных критериях больших температур. При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались различные вторичные породы с наиболее высочайшим содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий заходит в виде гидроокисей либо гидросиликатов. Но не любая алюминийсодержащая порода быть может сырьём для глинозёма – продукта, из которого с помощью способа электролиза получают алюминий.
Более нередко алюминий получают из бокситов. Залежи этого минерала всераспространены в странах тропического и субтропического пояса. В Рф также используются нефелиновые руды, месторождения которых размещаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
В бокситах содержится 40-60% глинозёма. Также в составе имеются оксид железа, диоксид титана, кремнезём. Для выделения незапятнанного глинозёма употребляют процесс Байера. В автоклаве руду нагревают с едким натром, охлаждают, отделяют от воды «красноватый шлам» (твёрдый осадок). Опосля осаждают гидроокись алюминия из приобретенного раствора и прокаливают её для получения незапятнанного глинозёма. Глинозём должен соответствовать высочайшим эталонам по чистоте и размеру частиц.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Потом способом электролиза глинозём превращают в алюминий. Заключительным шагом является восстановление действием Холла-Эру. Процесс заключается в последующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия. Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под веществом криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превосходит температуру плавления самого алюминия (660°С). Глубокую чистку алюминия проводят зонной плавкой либо дистилляцией его через субфторид.
Применение
Алюминий применяется в металлургии в качестве базы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на базе меди, железа, магния, никеля). Сплавы алюминия употребляются в быту, в архитектуре и строительстве, в кораблестроении и автомобилестроении, также в галлактической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ. Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) используют для производства бижутерии. Также сплав употребляется в электротехнике.
Разглядим, как употребляют разные изделия из алюминия.
Дюралевая лента представляет собой узкую дюралевую полосу шириной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Употребляется лента в пищевой, лёгкой, холодильной индустрии для производства охлаждающих частей и радиаторов.
Круглая дюралевая проволока применяется для производства кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Дюралевые трубы различаются долговечностью и стойкостью в критериях сельских и городских промышленных районов. Используются они в отделочных работах, дорожном строительстве, конструкции каров, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Дюралевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Употребляются они для концевого соединения железных тросов.
Дюралевый круг — это сплошной профиль круглого сечения. Употребляется это изделие для производства разных конструкций.
Дюралевый пруток применяется для производства гаек, болтов, валов, крепежных частей и шпинделей.
Около 3 мг алюминия любой денек поступает в человеческий организм с продуктами питания. Больше всего сплава в овсянке, горохе, пшенице, рисе. Учёными установлено, что он содействует действиям регенерации, провоцирует развитие и рост тканей, оказывает воздействие на активность пищеварительных желёз и ферментов.
При использовании дюралевой посуды в быту нужно держать в голове, что хранить и нагревать в ней можно только нейтральные воды. Если же в таковой посуде готовить, например, кислые щи, то алюминий поступит в пищу, и она будет иметь противный «железный» привкус.
Алюминий заходит в состав фармацевтических препаратов, применяемых при заболеваниях почек и желудочно-кишечного тракта.
Хим свойства алюминия
Одним из распространённых частей планетки является алюминий. Физические и хим свойства алюминия используются в индустрии. Все, что нужно знать, про этот сплав вы отыщите в нашей статье.
Строение атома
Алюминий – это 13 элемент повторяющейся таблицы. Он находится в 3-ем периоде, III группе, главной подгруппе.
Свойства и применение алюминия соединены с его электрическим строением. Атом алюминия имеет положительно заряженное ядро (+13) и 13 негативно заряженных электронов, располагающихся на трёх энергетических уровнях. Электрическая конфигурация атома – 1s 2 2s 2 2p 6 3s 2 3p 1 .
На наружном энергетическом уровне находится три электрона, которые определяют постоянную валентность III. В реакциях с субстанциями алюминий перебегает в возбуждённое состояние и способен отдавать все три электрона, образуя ковалентные связи. Как и остальные активные сплавы, алюминий является массивным восстановителем.
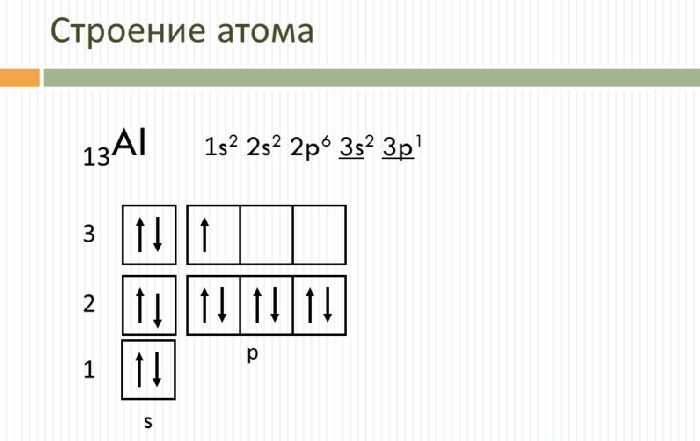
Рис. 1. Строение атома алюминия.
Алюминий – амфотерный сплав, образующий амфотерные оксиды и гидроксиды. Зависимо от критерий соединения проявляют кислотные либо главные свойства.
Физическое описание
- лёгкостью (плотность 2,7 г/см 3 );
- серебристо-серым цветом;
- высочайшей электропроводностью;
- ковкостью;
- пластичностью;
- температурой плавления – 658°C;
- температурой кипения – 2518,8°C.
Из сплава делают жестяные ёмкости, фольгу, проволоку, сплавы. Алюминий употребляют при изготовлении микросхем, зеркал, композитных материалов.

Рис. 2. Жестяные ёмкости.
Алюминий – парамагнетик. Сплав притягивается магнитом лишь в присутствии магнитного поля.
Хим свойства
На воздухе алюминий стремительно окисляется, покрываясь оксидной плёнкой. Она защищает сплав от коррозии, также препятствует взаимодействию с концентрированными кислотами (азотной, серной).
При обыденных критериях реакции с алюминием вероятны лишь опосля удаления оксидной плёнки. Большая часть реакций протекают при больших температурах.
Главные хим свойства элемента описаны в таблице.
Реакция
Описание
Уравнение
Пылает при больших температурах с выделением тепла
Ведет взаимодействие с сероватой при температуре выше 200°С, с фосфором – при 500°С, с азотом – при 800°С, с углеродом – при 2000°С
Реагирует при обыденных критериях, с йодом – при нагревании в присутствии катализатора (воды)
Реагирует с разбавленными кислотами при обыденных критериях, с концентрированными – при нагревании
Реагирует с аква смесями щелочей и при сплавлении
Теснит наименее активные сплавы
Алюминий не реагирует конкретно с водородом. Реакция с водой вероятна опосля снятия оксидной плёнки.

Рис. 3. Реакция алюминия с водой.
Что мы узнали?
Алюминий – амфотерный активный сплав с неизменной валентностью. Владеет маленький плотностью, высочайшей электропроводностью, пластичностью. Притягивается магнитом лишь в присутствии магнитного поля. Алюминий реагирует с кислородом, образуя защитную плёнку, которая препятствует реакциям с водой, концентрированными азотной и серной кислотами. При нагревании ведет взаимодействие с неметаллами и концентрированными кислотами, при обыденных критериях – с галогенами и разбавленными кислотами. В оксидах теснит наименее активные сплавы. Не реагирует с водородом.




























