Кристаллическая сетка
Твердые кристаллы можно представить как трехмерные конструкции, в каких верно повторяется один и этот же элемент структуры во всех направлениях. Геометрически верная форма кристаллов обоснована их строго закономерным внутренним строением. Если центры притяжения атомов, ионов либо молекул в кристалле изобразить в виде точек, то получим трехмерное постоянное распределение таковых точек, которое именуется кристаллической сеткой, а сами точки — узлы кристаллической решетки. Определенная наружная форма кристаллов является следствием их внутренней структуры, которая связана конкретно с кристаллической сеткой.
Кристаллическая сетка — это воображаемый геометрический образ для анализа строения кристаллов, который представляет собой объемно-пространственную сетчатую структуру, в узлах которой размещаются атомы, ионы либо молекулы вещества.
Для свойства кристаллической решетки употребляют последующие характеристики:
- Энергия кристаллической решетки Екр [КДж / моль] — это энергия, выделяющаяся при образовании 1 моля кристалла из наночастиц (атомов, молекул, ионов), которые находятся в газообразном состоянии и удалены друг от друга на такое расстояние, что исключается возможность их взаимодействия.
- Константа кристаллической решетки d [A0] — меньшее расстояние меж центрами 2-ух частиц в примыкающих узлах кристаллической решетки, соединенных хим связью.
- Координационное число — количество ближайших частиц, окружающих в пространстве центральную частичку и смешиваются с ней хим связью.
Основой кристаллической решетки является простая ячейка, которая повторяется в кристалле нескончаемое количество раз.
Простая ячейка — это меньшая структурная единица кристаллической решетки, которая обнаруживает все характеристики ее симметрии.
Упрощенно простую ячейку можно найти как малую часть кристаллической решетки, которая еще выявляет соответствующие индивидуальности ее кристаллов. Признаки простой ячейки описываются при помощи 3-х правил Бреве :
- симметрия простой ячейки обязана соответствовать симметрии кристаллической решетки;
- простая ячейка обязана иметь наибольшее количество схожих ребер а,b, с и схожих углов меж ними a,b,g. ;
- при условии соблюдения первых 2-ух правил простая ячейка обязана занимать малый размер.
Для описания формы кристаллов употребляют систему 3-х кристаллографических осей а, b, с, которые различаются от обыденных координатных осей тем, что они являются отрезками определенной длины, углы меж которыми a, b, g могут быть как прямыми, так и непрямыми.
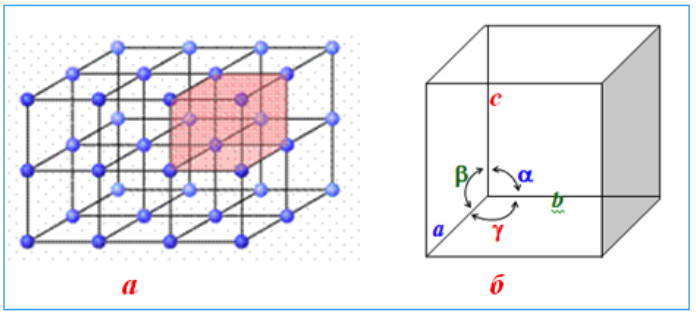 Модель кристаллической структуры: а) кристаллическая сетка с выделенной простой ячейкой; б) простая ячейка с обозначениями гранных углов
Модель кристаллической структуры: а) кристаллическая сетка с выделенной простой ячейкой; б) простая ячейка с обозначениями гранных углов
Форму кристалла изучает наука геометрическая кристаллография, одним из главных положений которой является закон всепостоянства гранных углов: для всех кристаллов данного вещества углы меж надлежащими гранями постоянно остаются схожими.
Если взять огромное количество простых ячеек и заполнить ими плотно друг к другу определенный размер, сохраняя параллельность граней и ребер, то появляется монокристалл безупречной строения. Но на практике почаще всего встречаются поликристаллов, в каких постоянные структуры есть в определенных границах, по которым ориентация регулярности резко изменяется.
Зависимо от соотношения длин ребер а, b, с и углов a, b, g меж гранями простой ячейки различают семь систем — так именуемых сингоний кристаллов. Но простая ячейка быть может построенной и таковым образом, что она имеет доп узлы, которые располагаются снутри ее размера либо на всех ее гранях — такие решетки именуются соответственно объемноцентрированными и гранецентрированными. Если доп узлы находятся лишь на 2-ух обратных гранях (верхний и нижний), то это базоцентрированная сетка. С учетом способности доп узлов существует всего 14 типов кристаллических решеток.
Наружная форма и индивидуальности внутреннего строения кристаллов определяются принципом плотной «упаковки»: более устойчивой, а поэтому и более возможной структурой будет таковая, которая соответствует более плотному расположению частиц в кристалле и в какой остается меньшее по размеру свободное место.
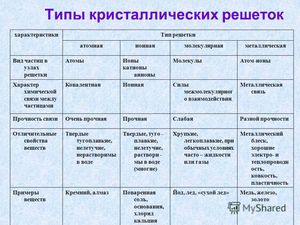
Типы кристаллических решеток
Зависимо от природы частиц, содержащихся в узлах кристаллической решетки, также от природы хим связей меж ними, различаются четыре главных типа кристаллических решеток.
Ионные решетки
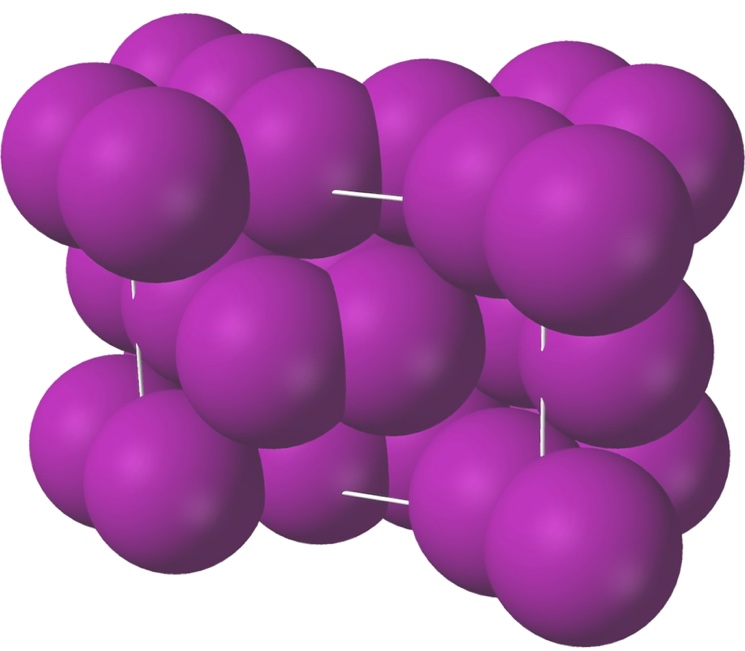
Ионные решетки построены из разноименных ионов, расположенных в узлах решетки и связанные силами электростатического притяжения. Потому структура ионной кристаллической решетки обязана обеспечить ее электронейтральность. Ионы могут быть ординарными (Na + , Cl — ) либо сложными (NH4 + , NO3 — ). Вследствие ненасыщенности и ненаправленности ионной связи ионные кристаллы характеризуются большенными координационными числами. Так, в кристаллах NaCl координационные числа ионов Na + и Cl — равна 6, а ионов Cs + и Cl — в кристалле CsCl — 8, так как один ион Cs + окружен восемью ионами Cl — , а любой ион — Cl — соответственно восемью ионами Cs + . Ионные кристаллические решетки образуются огромным количеством солей, оксидов и оснований.
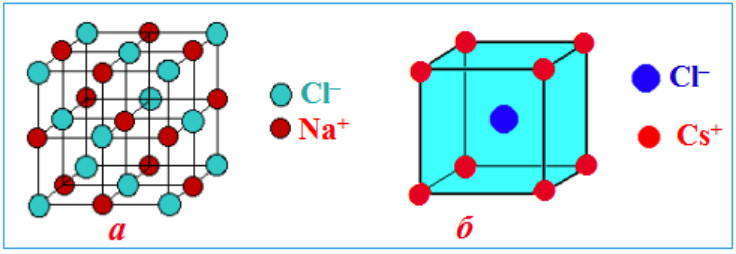 Примеры ионных кристаллических решеток: а) NaCl; б) CsCl
Примеры ионных кристаллических решеток: а) NaCl; б) CsCl
Вещества с ионными кристаллическими сетками имеют сравнимо высшую твердость, они довольно тугоплавкие, нелетучие. В отличие от металлов ионные соединения весьма хрупкие, потому даже маленькой сдвиг в кристаллической сетке приближает друг к другу одноименно заряженные ионы, отталкивания меж которыми приводит к разрыву ионных связей и как следствие — к возникновению в кристалле трещинок либо к его разрушению. В жестком состоянии вещества с ионной кристаллической сеткой относятся к диэлектрикам и не проводят электронный ток. Но при расплавлении либо растворении в полярных растворителях нарушается геометрически верная ориентировка ионов относительно друг дружку, поначалу ослабляются, а потом разрушаются хим связи, потому изменяются и характеристики. Как следствие, электронный ток начинают проводить как расплавы ионных кристаллов, так и их смеси.
Атомные решетки
Эти решетки построены из атомов, соединенных меж собой ковалентной связью. Они, в свою очередь, делятся на три типа: каркасные, слоистые и цепочечные структуры.
Каркасную структуру имеет, к примеру, алмаз — одно из самых жестких веществ. Благодаря sp 3 -гибридизации атома углерода строится трехмерная сетка, которая состоит только из атомов углерода, соединенных ковалентными неполярными связями, оси которых располагаются под схожими валентными углами (109,5 o ).
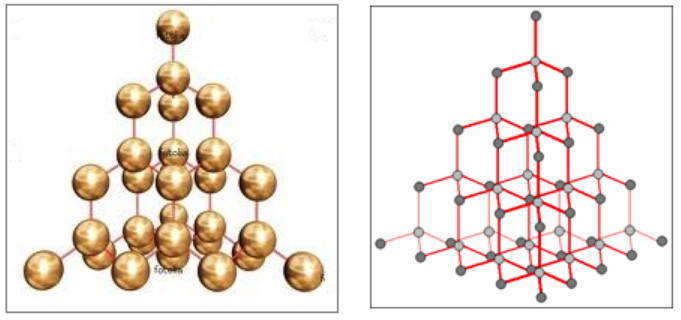 Каркасная структура атомной кристаллической решетки алмаза
Каркасная структура атомной кристаллической решетки алмаза
Слоистые структуры можно разглядывать как большие двумерные молекулы. Для слоистых структур присущи ковалентные связи снутри всякого слоя и слабенькое вандерваальсовское взаимодействие меж примыкающими слоями.
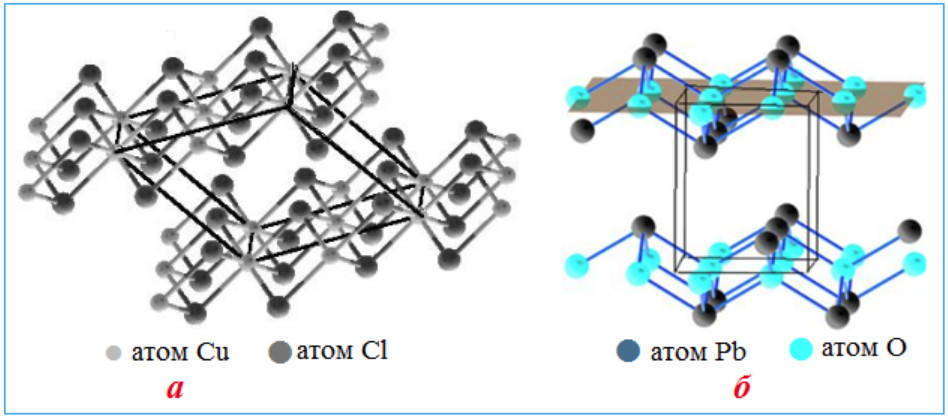 Слоистые структуры атомных кристаллических решеток: а) CuCl2 ; б) PbO. На моделях при помощи очертаний параллелепипедов выделены простые ячейки
Слоистые структуры атомных кристаллических решеток: а) CuCl2 ; б) PbO. На моделях при помощи очертаний параллелепипедов выделены простые ячейки
Традиционным примером вещества со слоистой структурой является графит, в каком любой атом углерода находится в состоянии sp 2 -гибридизации и образует в одной плоскости три ковалентные s-связи с 3-мя иными атомами С. Четвертые валентные электроны всякого атома углерода являются негибридизированными, за их счет образуются весьма слабенькие вандерваальсовские связи меж слоями. Потому при приложении даже маленького усилия, отдельные слои просто начинают скользить друг вдоль друга. Сиим разъясняется, к примеру, свойство графита писать. В отличие от алмаза графит отлично проводит электричество: под действием электронного поля нелокализованные электроны могут передвигаться вдоль плоскости слоев, и, напротив, в перпендикулярном направлении графит практически не проводит электронного тока.
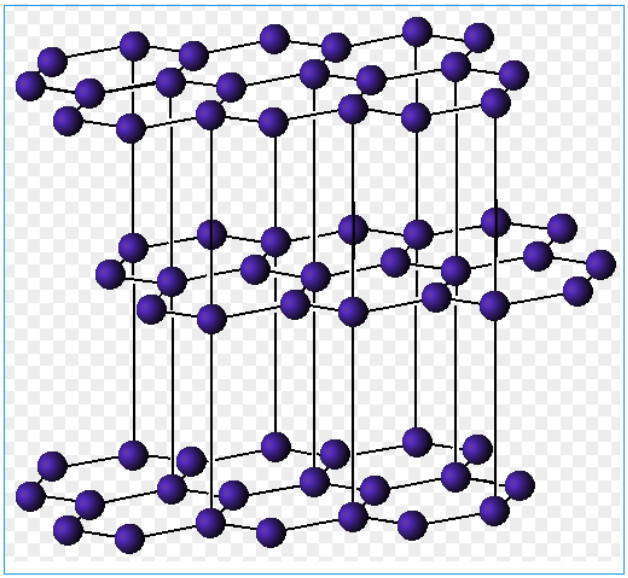 Слоистая структура атомной кристаллической решетки графита
Слоистая структура атомной кристаллической решетки графита
Цепочечные структуры свойственны, к примеру, для оксида серы (SO3)n , киновари HgS, хлорида бериллия BeCl2, также для почти всех бесформенных полимеров и для неких силикатных материалов, таковых, как асбест.
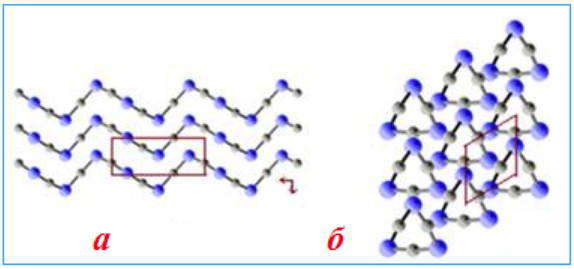 Цепная структура атомной кристаллической решетки HgS: а) проекция сбоку б) передная проекция
Цепная структура атомной кристаллической решетки HgS: а) проекция сбоку б) передная проекция
Веществ с атомной строением кристаллических решеток сравнимо незначительно. Это, обычно, обыкновенные вещества, образованные элементами IIIА- и IVA-подгрупп (Si, Ge, B, C). Часто соединения 2-ух различных неметаллов имеют атомные решетки, к примеру, некие полиморфные модификации кварца (оксид кремния SiO2 ) и карборунда (карбид кремния SiC).
Все атомные кристаллы различаются высочайшей прочностью, твердостью, тугоплавкостью и нерастворимостью фактически ни в каком растворителе. Такие характеристики обоснованы прочностью ковалентной связи. Вещества с атомной кристаллической сеткой имеют широкий спектр электронной проводимости от изоляторов и полупроводников до электрических проводников.
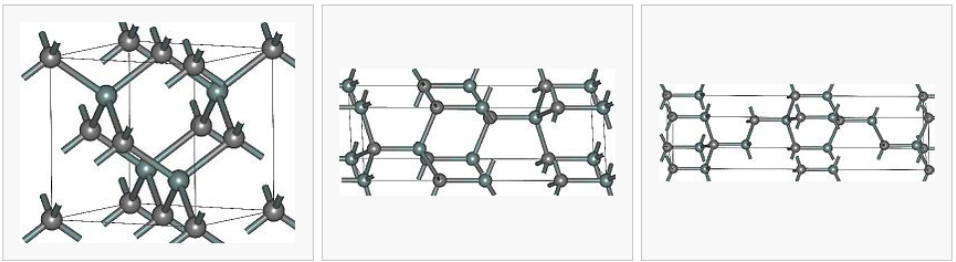 Атомные кристаллические решетки неких полиморфных модификации карборунда — карбида кремния SiC
Атомные кристаллические решетки неких полиморфных модификации карборунда — карбида кремния SiC
Железные решетки
Эти кристаллические решетки содержат в узлах атомы и ионы металлов, меж которыми свободно движутся общие для их всех электроны (электрический газ), которые образуют железную связь. Изюминка кристаллических решеток металлов заключается в огромных координационных числах (8-12), которые свидетельствуют о значимой плотность упаковки атомов металлов. Это разъясняется тем, что «остовы» атомов, лишены наружных электронов, располагаются в пространстве как шарики схожего радиуса. Для металлов почаще всего встречаются три типа кристаллических решеток: кубическая гранецентрированная с координационным числом 12 кубическая объемноцентрированная с координационным числом 8 и гексагональная, плотной упаковки с координационным числом 12.
Особенные свойства железного связи и железных решеток обусловливают такие важные характеристики металлов, как высочайшие температуры плавления, электро- и теплопроводимость, ковкость, пластичность, твердость.
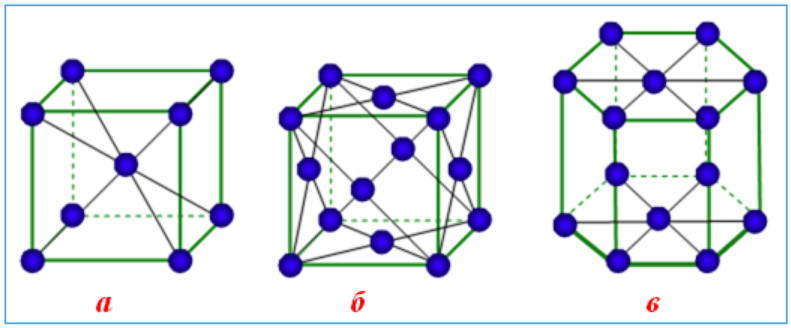 Железные кристаллические решетки: а) кубическая объемноцентрированная (Fe, V, Nb, Cr) б) кубическая гранецентрированная (Al, Ni, Ag, Cu, Au) в) гексагональная (Ti, Zn, Mg, Cd)
Железные кристаллические решетки: а) кубическая объемноцентрированная (Fe, V, Nb, Cr) б) кубическая гранецентрированная (Al, Ni, Ag, Cu, Au) в) гексагональная (Ti, Zn, Mg, Cd)
Молекулярные решетки
Молекулярные кристаллические решетки содержат в узлах молекулы, соединенные меж собой слабенькими межмолекулярными силами — вандерваальсовскими либо водородными связями. К примеру, лед состоит из молекул воды, удерживающихся в кристаллической сетке водородными связями. К тому же типу относятся кристаллические решетки почти всех веществ, переведенных в жесткое состояние, к примеру: обыкновенные вещества Н2, О2, N2, O3, P4, S8, галогены (F2, Cl2, Br2, I2), «сухой лед» СО2, все великодушные газы и большая часть органических соединений.
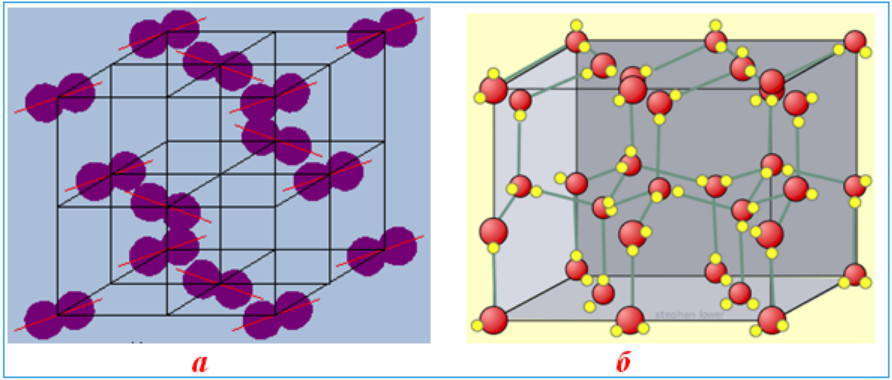 Молекулярные кристаллические решетки: а) йод I2 ; б) лед Н2О
Молекулярные кристаллические решетки: а) йод I2 ; б) лед Н2О
Так как силы межмолекулярного взаимодействия слабее, чем силы ковалентной либо железной связи, молекулярные кристаллы имеют маленькую твердость; они легкоплавкие и летучие, нерастворимые в воде и не проявляют электропроводности.
Твердые вещества и их строение зависимо от типа кристаллической решетки
Твердые вещества состоят из крепко связанных меж собой атомов, молекул и ионов. Характеристики жестких тел зависят от прочности хим связей снутри их.
Большая часть жестких веществ имеют кристаллическую структуру. Их частички — молекулы, атомы либо ионы — размещены в серьезном порядке. Таковая постоянная структура именуется пространственной, либо кристаллической, сеткой.
Тип кристиаллической решетки жестких веществ
Тип решетки зависит от того, какие частички находятся в узлах решетки. Существует 4 главных типа пространственных решеток — ионная, молекулярная, атомная и железная.
С увеличением температуры энергия колебаний частиц твердого вещества возрастает, и когда она превосходит энергию межмолекулярного притяжения, кристаллическая сетка разрушается — происходит плавление.
Ионная структура
Вещества с ионной структурой, к примеру хлорид натрия, обычно имеют достаточно высочайшие температуры плавления. Это свойство вытекает из мощного взаимодействия меж обратно заряженными ионами решетки. В тоже время ионные вещества довольно хрупкие. Силой, приложенной кристаллу снаружи, можно сдвинуть слои ионов, так что идиентично заряженные ионы окажутся друг напротив друга. Они начнут отталкиваться, слои раздвигаться, и кристаллическая сетка в этом месте разрушится. Смеси и расплавы таковых соединений отлично проводят электронный ток.
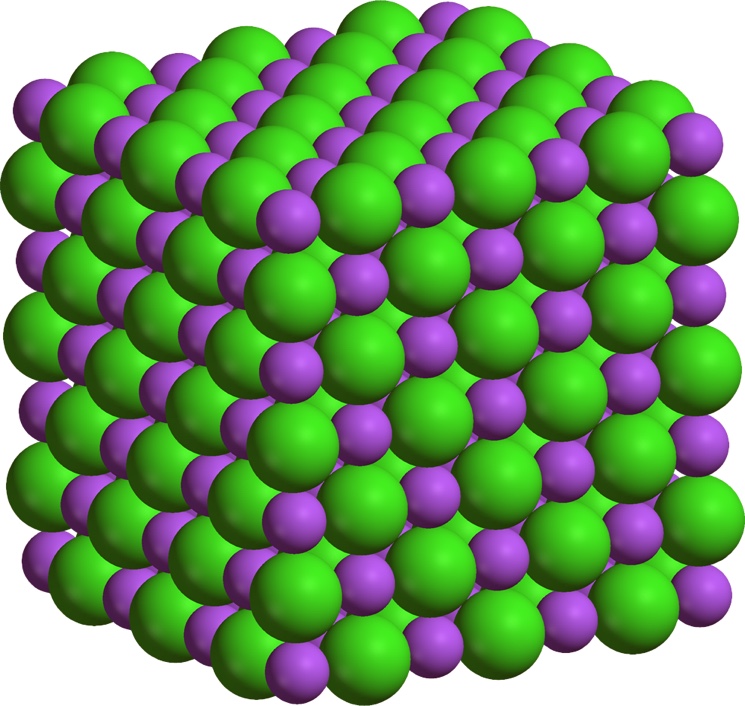
На рисунке пространственная модель кубической решетки кристалла хлорида натрия. Тут показаны относительные размеры 2-ух типов ионов и их размещение в пространстве.
Молекулярная структура жестких веществ
В узлах атомной решетки находятся атомы. Молекулы состоят из атомов, связанных крепкой ковалентной связью. К примеру, молекулы йода состоит из 2-ух атомов, связанных схожей ковалентной связью. Связи меж молекулами и жестких веществ не настолько высокопрочны.
Молекула йода I 2 . Жесткий йод состоит из молекул йода, связанных в регулярную кристаллическую сетку. Любая молекула йода состоит из 2 крепко связанных меж собой атомов йода.
Йод в жестком состоянии довольно мягенький элемент, так как связи меж его молекулами слаб.

Твердые вещества с молекулярной структурой плавятся, обычно, при низких температурах. При плавлении ковалентные связи не рвутся, разрушаются лишь связи меж слабо взаимодействующими вместе молекулами.
Атомная структура
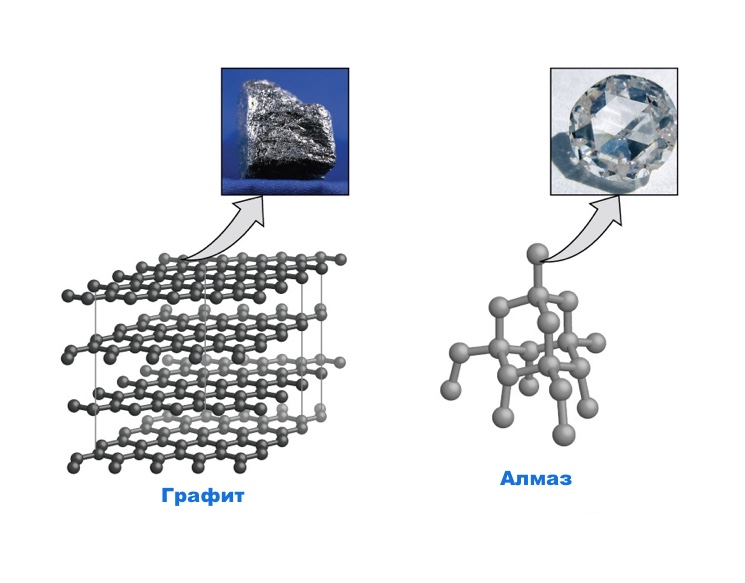
Вольный углерод известен в 2-ух модификациях — алмаз и графит. И алмаз и графит состоит лишь из атомов углерода, но эти два вещества имеют совсем различные структуры. В графите атом углерода соединен с 3 иными атомами маленькими крепкими ковалентными связями. 4-ый электрон остается вольным, что обусловливает электропроводность графита. Шестиугольные кольца образуют плоские слои.
Связи меж слоями достаточно слабенькие, и слои могут скользить один относительно другого. Конкретно потому графит употребляют как жесткий смазочный материал. В алмазе любой атом углерода соединен крепкими ковалентными связями с 4 иными атомами. Млрд атомов соединены в трехмерную кристаллическую сетку необыкновенной прочности, что делает алмаз самым жестким из узнаваемых веществ.
Непременно, алмаз встречается намного пореже, чем графит, и еще ценнее его. И алмаз и графит состоят лишь из атомов углерода, но эти 2 вещества имеют совсем различные структуры, и как следует, совсем различные своства. На рисунке показана структура кристаллической решетки алмаза.
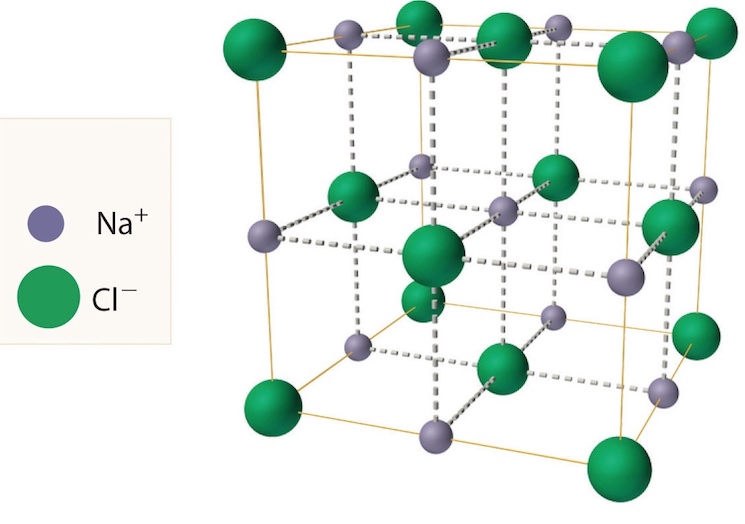
Кристаллы из поваренной соли состоят из ионов натрия и хлорид ионов. На рисунке атомы показаны в виде шариков. Шарики условно разнесены, чтоб усло была видна трехмерная структура кристалла.
Карандашный грифель изготовлен из графита. Слабенькие силы притяжения меж слоями атомов углерода разрешают слоям скользить относительно друг-друга, вот потому на бумаге и остается графитовый след.
Железная структура жестких веществ
В узлах веществ с железной сеткой находятся положительные ионы и атомы металлов, а меж узлами — электроны. Атомы плотно упакованы слоями, при этом атомы 1-го слоя приходятся на углубление примыкающего слоя. Взаимодействия меж атомами в таковой структуре достаточно сильны, и большая часть металлов имеют высочайшие температуры плавления.
Огромное количество электронов могут свободно передвигаться по всему кристаллу сплава, и потому именуются вольными электронами. Вольные электроны имеют отрицательный заряд и притягивают катионы металлов, в итоге что кристаллическая сетка металлов является устойчивой. Вольные электроны могут свободно переносить теплоту и электричество, потому они являются предпосылкой основных физических параметров, отличающих сплавы от неметаллов, — высочайшей электро- и теплопроводимости.
Атомы сплава в жестком состоянии плотно упакованы. Наружные электроны свободно передвигаются и умеренно распределены меж всеми атомами. Единое электрическое скопление крепко связывает атомы вместе.
При прохождении электронного тока через сплав суммарный поток электронов имеет определенное направление — от отрицательного полюса к положительному.
Проводимость графита — редчайший пример проводника неметалла
Электронный ток — это направленный поток заряженных частиц. Таковыми заряженными частичками могут быть ионы либо электроны, способные свободно передвигаться. В неких вариантах способность материала проводить либо не проводить электронный ток дозволяет судить о его структуре.
Графит проводит ток, так как любой атом углерода в его структуре соединен ковалентно лишь с 3 иными атомами. Таковым образом, 1 (4-ы) электрон у всякого атома остается относительно вольным, принимая роли в образовании связи, «размазанной» по всему слою атомов. Таковая связь именуется делокализованной. Она является источников электронов, способных свободно передвигаться по слоям графита проводить электронный ток.
Увлекательное видео, в каком наглядно показана не только лишь проводимость графита, да и образование электронной дуги меж графитовыми стержнями.
Когда вещества с ионными связями (соли) расплавлены либо растворены в воде, кристаллическая сетка разрушается, ионы стают вольными и могут проводить электричество. Это явление посодействовало в свое время ученым осознать, что ионные вещества состоят из заряженных частиц.
Достойные внимания опыты с диоксидом углерода либо жестким льдом
На видео проведен опыт, в каком 90 сухого льда вываливают в надувной бассейн.
При -78,5 0С жесткий диоксид углерода (сухой лед) преобразуется в углекислый газ, минуя жидкое состояние. Если кинуть сухой лед в воду, он начнет испаряться. Смесь сухого льда и воды употребляют для сценических эффектов (густой туман).
Таблица типов кристаллических решёток: йода, алмаза, графита, натрия

Химия — умопомрачительная наука. Столько неописуемого можно найти в, чудилось бы, обыденных вещах.
Всё вещественное, что окружают нас всюду, существует в нескольких агрегатных состояниях: газы, воды и твёрдые тела. Учёные выделили ещё и 4-е — плазму. При определённой температуре какое-либо вещество может перебегать из 1-го состояние в другое. К примеру, вода: при нагревании выше 100, из водянистой формы, преобразуется в пар. При температуре ниже 0 перебегает в последующее агрегатную структуру — лёд.
Весь вещественный мир имеет в своём составе массу схожих частиц, которые меж собой соединены. Эти мелкие элементы строго выстраиваются в пространстве и образуют так именуемый пространственный основа.
Это любопытно: анионы и катионы в химии, таблица растворимости.
Определение

Кристаллическая решётка — особенная структура твёрдого вещества, при которой частички стоят в геометрически серьезном порядке в пространстве. В ней можно найти узлы — места, где размещены элементы: атомы, ионы и молекулы и межузловое место.
Твёрдые вещества, зависимо от спектра больших и низких температур, являются кристаллическими либо бесформенными — они характеризуются отсутствием определённой температуры плавления. При действии завышенных температур они размягчаются и равномерно перебегают в водянистую форму. К такового рода субстанциям относятся: смола, пластилин.
В связи с сиим можно поделить на некоторое количество видов:
- атомную;
- ионную;
- молекулярную;
- железную.
Но при разных температурах одно вещество может иметь разные формы и проявлять разнообразные характеристики. Это явление именуется аллотропной модификацией.
Это любопытно: сплавы и неметаллы в повторяющейся таблице Менделеева.
Атомный тип
В этом типе в узлах размещены атомы того либо другого вещества, которые соединены ковалентными связями. Этот вид связи образован парой электронов 2-ух примыкающих атомов. Благодаря этому они связываются умеренно и в серьезном порядке.
Вещества с атомной кристаллической решёткой характеризуются последующими качествами: крепкость и большая температура плавления. Таковой тип связи представлен у алмаза, кремния и бора.
Ионный тип
Обратно заряженные ионы находятся на узлах, которые делают электромагнитное поле, характеризующее физические характеристики вещества. К таким будут относиться: электропроводность, тугоплавкость, плотность и твёрдость. Поваренная соль и нитрат калия характеризуются наличием ионной кристаллической решётки.
Не пропустите: механизм образования железной связи, определенные примеры.
Молекулярный тип
В узлах такового типа находятся ионы, связанные меж собой ван-дер-ваальсовыми силами. Благодаря слабеньким межмолекулярным связям такие вещества, к примеру, лёд, двуокись углерода и парафин, характеризуются пластичностью, электро- и теплопроводимостью.
Железный тип
В своём строении припоминает молекулярную, но имеет всё же наиболее крепкие связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электронного поля. Они ещё носят заглавие электронного газа.
Обыкновенные сплавы и сплавы, характеризуются железным типом решётки. Для их типично наличие железного блеска, пластичность, тепло- и электропроводность. Они могут расплавляться при разных температурах.
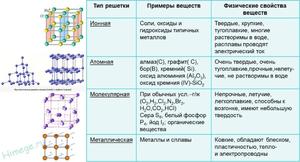
| Виды | Вещества | Характеристики |
| Атомная | Алмаз, графит, кремний, бор | Твёрдые, тугоплавкие, не растворяются в воде |
| Молекулярная | Йод, сера, белоснежный фосфор, органические вещества | Нетвёрдые, просто плавятся, летучие |
| Ионная | Соли, оксиды и гидроксиды тяжёлых металлов | Твёрдые, хрупкие, легкоплавкие, электропроводны |
| Железная | Сплавы и сплавы | Блестящие, ковкие, тепло- и электропроводны. |
Разные вещества
- Алмаз. Минерал владеет высочайшей ценностью и опосля огранки употребляется в ювелирных украшениях. Так в чём же заключается секрет популярности этого камня? Атомы углерода составляют базу всей решётки. Меж атомами минерала существует крепкая ковалентная связь. Для кристаллической решётки алмаза типично плотное содержание атомов в виде куба. Иными словами, узлами числятся атомы углерода, а типичными гранями куба являются крепкие ковалентные связи. Таковой минерал считается самым крепким на планетке, и непонятно, сколько таковых типичных кубов содержит в себе цельный алмаз.
- Графит. Углерод также быть может и в иной кристаллической модификации. Атомная решётка данного элемента содержит в себе лишь атомы углерода, ей присуща слоистая структура. В графите любой атом связан 3-мя атомами углерода. Из-за этого он владеет железным блеском, высочайшей теплопроводимостью.
- Кристаллическая решётка йода имеет молекулярный тип. Атомы молекул соединяются ковалентными связями, но молекулы хим элемента имеют слабенькие силы притяжения. Это охарактеризовывает йод тем, что он имеет малую твёрдость, низкую температуру плавления.
- Натрий. Представитель железной кристаллической решётки. Меж катионами, расположенными в узлах решётки, двигаются электроны. Они, присоединяясь к катионам, нейтрализуют их заряд, в свою очередь, нейтральные атомы отпускают часть электронов, преобразуясь в катионы. Таковой тип кристаллической решётки наделяет сплав пластичностью, электро- и теплопроводимостью.
- Сухой лёд. Либо оксид углерода в затвердевшем виде. Имеет молекулярную кристаллическую решётку в форме куба. Молекулы удерживаются меж собой слабенькими связями. Диффузия читайте в нашей статье.






























