Индивидуальности сплава алюминия: его свойства, достоинства и свойства

Алюминий — это самый всераспространенный сплав в земной коре, который встречается в виде изотопа. Его активная добыча связана с широкой сферой внедрения. Благодаря низкой теплопроводимости, стойкости к действию коррозии, большенный тугоплавкости и жароустойчивости без этого сплава не обходится ни одна сфера производства.
Индивидуальности алюминия
Сам сплав владеет белоснежным цветом и хим активностью. Вступая в реакцию с воздухом, на его поверхности появляется оксидная пленка, которая защищает его от действия воды и иных негативных причин, выступающих в роли раздражителей. Таковая реакция не только лишь выступает преимуществом сплава, но и в неком роде является недочетом, корректируя процесс литья.
Дальше рассмотрены достоинства и недочеты эматалирования, анодированного и остальных видов алюминия, также его систематизация.
Данное видео ознакомит вас с чертами алюминия:
Достоинства и недочеты
Благодаря собственной структуре и чертам, алюминий владеет последующими преимуществами:
- Маленькая масса;
- Устойчивость к коррозии;
- Высочайший коэффициент поглощения звука;
- Экологическая сохранность;
- Устойчивость к температурным перепадам;
- Долговечность;
- Возможность корректировки черт благодаря примесям.
Что касается недочетов, то можно отметить только высшую стоимость, по сопоставлению с иными сплавами. Но достоинства эту изюминка делают наименее важной.
Систематизация

Алюминий довольно изредка употребляется конкретно в чистом виде, чтоб получить нужные функции и технические свойства, в сплав добавляются особые примеси. Если предел прочности незапятнанного сплава составляет 90 МПа, то при добавке легирующих компонент (магний, цинк и прочее) этот показатель можно прирастить до 700 МПа.
Такие дюралевые сплавы можно поделить на две группы:
- Деформируемые сплавы. Для их производства сплав разливается вначале в особые слитки, которые потом обрабатываются под высочайшим давлением одним из способов.
- Литейные сплавы. Они различаются завышенным содержанием кремния и необходимостью литья уже в готовые формы.
Про температуру плавления и кипения алюминия, другие химические свойства и свойства сплава побеседуем ниже.
Свойства и свойства
Физические свойства данного сплава зависят впрямую от его чистоты. Если состав алюминия очень приближен к единице, то в итоге достигаются очень вероятные свойства. Конкретно потому он совершенно подступает для ковки, штамповки и остальным способам обработки.
Отличительной чертой алюминия является возможность внедрения различных типов сварки. Не считая этого сплав владеет последующими чертами:
- Маленький коэффициент плотности, который составляет 2,7 г/см³. От этого показателя зависит также его крепкость, которая также невелика. Конкретно по данной нам причине алюминий в чистом виде не употребляется в конструкционных целях.
- Высочайший коэффициент теплопроводимости. Незапятнанный сплав при температуре 200°C владеет теплопроводимостью в 209 Вт/(м*К).
- Температура плавления у алюминия технического типа составляет 657 °C, а у незапятнанного — 660 °C.
- Удельная теплоемкость составляет 880 Дж/кг·K.
- Температура кипения — 2500 °C.
Дальше рассмотрены структура и хим состав алюминия.
Структура и состав
Структура алюминия представлена кубической сеткой из кристаллов. Малое расстояние меж 2-мя атомами составляет от 2,863Å. Кристаллическая сетка имеет стабильность при температурных критериях от 4К до конкретной температуры плавления. Наличие примесей фактически не влияет на структуру алюминия.
Кроме незапятнанного алюминия в состав могут заходить примеси из цинка, кремния, магния и остальных металлов. Дальше мы разглядим получение и применение алюминия на базе его хим и физических параметров.
О том, как верно расплавить алюминий с помощью газовой плиты, скажет видеоролик ниже:
Процесс производства
Технологический процесс получения данного сплава содержит в себе три шага:
- Получение глинозема из первичного сырья (содержащие алюминий руды).
- Создание из получившегося глинозема технического алюминия.
- Процесс наибольшей чистки сплава.
Получение оксида алюминия происходит из глинозема под действием электролиза. Соединение обязано быть очень незапятнанным, так как на этом шаге его получения очень проблематично избавиться от ненадобных примесей.
Чтоб получить алюминий с чистотой приближенной к единице, нужно организовать несколько цехов для его обработки, любой из которых будет отвечать за определенный шаг производства. Конкретно потому незапятнанный сплав имеет довольно высшую стоимость, которая добивается до 1700 баксов за 1 т (1000 кг алюминия).
Области внедрения

Технические свойства и возможность подвергать алюминий разным обработкам определили его обширное распространение. А именно сплав интенсивно употребляется в последующих областях:
- Авиастроение;
- Автопромышленность;
- Ракетостроение;
- Создание посуды;
- Пищевая индустрия;
- Кораблестроение;
- Микроэлектроника;
- Энергетика и почти все другое.
Часто в процессе эксплуатации алюминия используют в симбиозе с иными сплавами, к примеру, железом, титаном, никелем, бронзой, медью и т.п. Индивидуальности алюминия, его технические свойства и обширное распространение сделали этот сплав очень нужным. Ни она современная область индустрии не обходится без его внедрения.
Как паять алюминий без специального флюса, поведает этот видеосюжет:
Конфигурация и формула строения атома алюминия
1-ое пространство посреди узнаваемых металлов, находящихся в земной коре, занимает тринадцатый элемент в повторяющейся таблице Менделеева — алюминий. Строение атома дозволяет элементу владеть высочайшей электропроводностью и пластичностью. До момента открытия промышленного метода сотворения вещества оно стоило дороже золота. Из-за высочайшей сопротивляемости коррозии и низкого веса сплав нашёл обширное применение в строительстве, быту, электрике и даже фармацевтике.

Физические и химические свойства
Процесс получения алюминия несложен. Современный метод разработал южноамериканский учёный Чарльз Холл. Что любопытно, незначительно позднее этот способ употреблял французский химик Поль Эру, незнакомый с исследовательскими работами янки. Сущность сотворения алюминия заключается в растворении оксидированного алюминия в растворе криолита. Потом в жидкость погружают графические электроды. Недочет способа заключается в огромных издержек электроэнергии, потому интенсивно он начал употребляться лишь сначала двадцатого века.

К полезным свойствам алюминия относят его маленькую плотность — она в три раза меньше, чем у железа и меди. Материал характеризуется достаточно неплохой прочностью, имеет коррозийную стойкость и хорошую теплопроводимость. Из-за собственных черт он нашёл обширное применение как технический материал.
Отсутствие вредных примесей для людского организма в веществе, податливость к штамповке и лёгкость дозволили использовать элемент при изготовлении промышленной и бытовой фольги, кухонной посуды.
В природе алюминий содержится лишь в минералах.
Его можно извлечь из последующих соединений:

- Гидроокисла — Al2O3 * H20. Бокситы представляют собой глиноподобную массу. Это одна из более принципиальных руд алюминия.
- Алюмосиликата калия и натрия — (Na, K) AlSiO4. Породообразующий материал (элеолит) с шестиугольной кристаллической системой.
- Квасцового камня — KAl3 (SO4)2 (OH)6. Алунит создается при действии сернокислых вод с силикатами, что создаёт окись алюминия.
- Корунда — Al2O3. Кристаллический глинозём с высочайшей твёрдостью.
- Силиката — Al2O3. Породообразующий материал, содержащий порядка 19% оксида алюминия в своём составе.
Не считая этого, элемент можно извлечь из каолина, известняка, магнезита. В хим реакция вещество проявляет себя как восстановитель. С галогенами при температуре 20−24 градуса по Цельсию он создает галогениды: 2Al + 3Cl2 = 2AlCl3. С иными субстанциями создаёт бинарные соединения. К примеру, Al + P = AlP, 4Al + 3C = Al4C3, 2Al+ 3F2 = 2AlF3. При содействии этих соединений с водой образуются гидроксиды и летучие водородные соединения.
С сплавами сформировывает сплавы с интерметаллическими соединениями.
При содействии с кислотами результатом реакции стают соли. Очищенный алюминий от оксида вступает в активную реакцию с водой: 2Al + 6 H2O = 2 Al (OH)3 + 3H2.
Свойства элемента
Алюминий — элемент семейства лёгких металлов, уступающий в распространённости лишь кислороду и кремнию. В повторяющейся таблице он размещается на тринадцатом месте, имеет серебристо-белый цвет. Принятое хим обозначение — Al (от латинского слова aluminium).
Вещество имеет последующие свойства:

- Относительная атомная масса — 26,981538. Указывает, во сколько раз атом алюминия превосходит вес атомной единицы массы, принятой равной 1,67 * 10 -27 кг.
- Атомный номер — 13. Обозначает число протонов в ядре вещества равное количеству электронов, крутящихся вокруг атома.
- Радиус атома — 143 пикнометра. Определяется расстоянием меж ядром и самой удалённой орбитой элемента.
- Ковалентный радиус — 121 пикнометр. Расстояние меж ядрами, формирующими ковалентную связь и делённое на 2.
- Электрическая формула атома алюминия — 1s 2 2s 2 2p 6 3s 2 3p 1 . Число электронов в оболочках в согласовании с энергетическим состоянием.
- Фазовые температуры — при достижении 660 градусов по Цельсию происходит плавление, а при 2518 °C закипание.
- Способность атомов задерживать электроны (электроотрицательность) — 1,61 по Полингу.
- Степень окисления — 3,0. Находится по числу электронов, смещённых от либо к атому.
- Плотность — 2,7 г/см 3 . Отношение массы алюминия к его объёму.
- Молярный размер = 10,0 см 3 /моль. Определяется отношением объёма вещества к количеству.
В первый раз искусственно алюминий был сотворен в 1825 году. Получить его смог датский учёный Эрстед. В ядре вещества содержится 13 протонов и больше на один нейтронов. Всего же общее число приравнивается 27. Электроны размещаются на 3-х энергетических уровнях. На первом расположены 2 электрона, на втором 8 (три пары), а на 3-ем 3. Такое положение соответствует записи: +13Al)2)8)3.

При всем этом если атом возбудить, то в этом состоянии все три элемента могут быть отданы, тем достигая степени окисления +3 либо вызывать образование ковалентных связей. Отсюда следует, что валентность алюминия приравнивается трём. В природе вещество встречается в глине, слюде, корунде. Ведет взаимодействие со почти всеми элементами, а вот с водородом нет.
При соприкосновении с кислородом образует оксидную плёнку, препятствующую реакциям с водой и азотной и серной кислотой.
Электрическая конфигурация
Алюминий можно отыскать в таблице Менделеева в третьей группе главной подгруппы. Распределение зарядов по орбитали описывается как 1s22s22p63s23p1. Алюминий в повторяющейся таблице имеет тринадцатый номер, потому что атом элемента состоит из 13-ти электронов. В электрической конфигурации сумма верхних индексов как раз и составляет это число: 2+2+6+2+1 =13.
Иными словами, верхние индексы демонстрируют количество заряда, распределённого по слоям и орбиталям. Если изобразить схему строения электрической оболочки атома алюминия, можно отметить, что крайним заполняемым слоем будет р-орбиталь. А это означает, что вещество принадлежит семейству р-элементов.

Алюминий расположился в 3-ем периоде. Это означает, что у него 3 электрических слоя. На первом находится s-орбиталь, 3 орбитали расположились на p-слое, и 5 на d-орбитали. На 3d-орбитали пусто, на неё электронов не хватило. На любом слое не быть может наиболее 2-ух электронов. Заполняются же орбиты, начиная со слоев с наименьшей энергией. На теоретическом уровне существует возможность возбужденного состояния для атома элемента за счет существования вольной 3d-орбитали. Но распаривания ионов 3s-подуровня на практике не происходит.
Поначалу электроны располагаются в первом слое, позже во 2-м, а уже потом в 3-ем. Орбитали всякого слоя заполняются с внедрением принципа наименьшей энергии. Так, поначалу запирается s-орбиталь, потом каждой орбитали достаётся по одному электрону, а потом по второму. Если их хватает, заполняются оставшиеся наружные р-орбитали.
В атоме алюминия стопроцентно заполняются орбитали первых 2-ух электрических слоев. На первом располагается 2 электрона, а на втором 8 носителей заряда. Два располагаются на s-орбиталь и по 2 на 3 р-орбитали. На 3-ий слой переместятся 3 электрона: 13 — 8 — 2 = 3.
В согласовании с законом поначалу до максимума зарядами заполняется s-орбиталь третьего слоя, а на три р-орбитали хватает лишь 4 электрона. Из их 3 простые частички занимают свою орбиталь, а опосля одна из р-орбиталей приобретает парный электрон.
Составление строения
На уроках химии в седьмом классе ученикам демонстрируют, как графически изображают электрические формулы разных частей. При составлении конфигураций учитывают правила Паули и Клечковского (Хунда). Модель записывается для атомов, находящихся в возбуждённом состоянии. При составлении учитывают, что порядковый номер периода элемента описывает количество энергетических оболочек, а порядок — число носителей заряда.
Беря во внимание, что согласно правилу Клечковского, энерго уровни заполняются в согласовании с порядком возрастания головного и орбитального квантового числа, употребляют формулу n + 1. Так, действует последующее правило: 1 s < 2 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 5 d ≈ 4 f < 6 p. Перемещение атомов происходит согласно запрещенному принципу. Определил его Паули. Он утверждал, что на одной орбитали могут поместиться лишь 2 иона, хорошие квантовым числом спина.

Из его утверждения следует, что количество электронов на энергетических уровнях соответствует квадрату головного квантового числа, умноженному на 2. Форма обозначения предполагает, что основное квантовое число обозначают арабской цифрой. Потом записывают буковку, определяющую энергетический подуровень, характеризующий орбитальное квантовое число. Верхний индекс показывает на число электронов, формирующих подуровень.
При заполнении энергетических подуровней следует придерживаться правила Хунда. В согласовании с ним, частички стремятся добиться большего суммарного спина. Для валентных ионов алюминия электронно-графическая формула изображается с внедрением квадратов и стрелок. Ячейки обозначают орбитали, а стрелки — спины. В одном квадрате не быть может больше 2-ух электронов.
На первом уровне (s) для алюминия отрисовывают один квадрат с 2-мя стрелками. На втором (p) необходимо изобразить 4 квадрата с заполненными стрелками.
На наполнение третьего уровня остаётся лишь 3 электрона, потому на крайнем уровне (d), будет нарисовано лишь 2 квадрата, при всем этом во 2-ой помещена лишь одна стрелка.
Исследование темы "Алюминий и его свойства" с помощью инноваторских технологий «Круговерть»

Низомова, С. О. Исследование темы «Алюминий и его свойства» с помощью инноваторских технологий «Круговерть» / С. О. Низомова. — Текст : конкретный // Педагогическое мастерство : материалы II Междунар. науч. конф. (г. Москва, декабрь 2012 г.). — Москва : Буки-Веди, 2012. — С. 131-134. — URL: https://moluch.ru/conf/ped/archive/65/3040/ (дата воззвания: 05.11.2021).
В данной статье дано несколько вид опросов по новейшей либо по пройденной теме. Опрос учеников проводится в групповом виде, личном виде, с применением приятных пособий, зарисовки, чертежи, экспериментальные задачки, также демо опыты. В течение урока с внедрением несколько типов педагогических, интерактивных, инноваторских способов эффективность образования увеличивается и улучшается свойства обучения предмета.
In this article several types questioning on new or on previous subject are given. Questioning pupil is conducted in groups and in individual modes by using the visual aids, schemes, drawings, experimental problems, as well as demonstration experiments. During the lessons effectiveness of education will be increased and quality indicators will be achieved by using several types of pedagogical, interactive, innovative methods.
Узбекистан богат не только лишь природными ресурсами и различной индустрией, но и научно-техническими опытнейшеми кадрами, также научной базой. Развитие научно-технических кадров, их действенное использования экономики Республики Узбекистан, так как в ХХ I веке ведущая роль во всех сферах народного хозяйства обеспечивается реализаций результатов умственной деятельности. Происходящие в стране публичные, экономические и технологические конфигурации осязаемо влияют на образование, систему подготовки кадров, процесс воспитания всесторонне развитого, здорового поколения и требуют к для себя нестандартных подходов, мыслях.
Инноваторские идеи, будучи общественно необходимыми в публичном развитии, требуют новейших концепций, технологий и составляют определенную систему. Инновационное образование — это внедрение новейших технологий, новейших образовательных действий в обучение (педагогический процесс, в результате которого учащиеся под руководством учителя овладевают знаниями, умениями и навыками). Интерактивные способы помогают учащимся отлично усвоить изучаемый материал, развить внутри себя творческие возможности, также найти личностные свойства всякого учащегося и тем подобрать на более пригодную методику обучения.
обеспечить энтузиазм к теме занятия,
развивать аналогическое мышление,
развивать аналогическое мышление,
сформировывать коммуникативные способности,
создавать условия для вовлечения всех обучаемых в активную учебную деятельность,
В истинное время, в связи с внедрением в процессе обучения интерактивных способов изо денька в денек усиливается энтузиазм, внимания к увеличению свойства обучения на упражнениях с внедрением современных технологий и познания, получаемые учащимся ориентированы не только лишь на то, чтоб учить без помощи других, находить самим, рассматривать, но и созодать выводы. Учитель в этом процессе создаёт нужные условия для развития, формирования, получения познаний, воспитания личности и коллектива, вместе с сиим делает должность возглавляющего и направляющего.
При исследовании темы «Алюминий и его свойства» с помощью инноваторских технологий мы покажем некоторое количество видов инноваторских технологий.
Черта: Это разработка дозволяет применять в учебном процессе, также во вне учебное время различную литературу, уяснить изученный материал, тексты, пересказывать за куцее время получить огромную информацию.
Цель» Контроль и оценка личного и группового усвоения учащимся раздаточного материала.
Внедрение» практические и лабораторные занятия, также урок-беседа, урок-обсуждение, урок-презентация, персональной, групповой и коллективной форме.
Применяемые средства обучения»самостоятельное чтение по пройденной либо новейшей теме в процессе урока, раздаточный материал для исследования и усвоения темы, схемы-рисунки, уравнения реакций, бумаги формата А-4 фломастер либо цветные карандаши и цветные бумаги.
Тема: Исследование темы «Алюминий и его свойства» с помощью инноваторских технологий по способу « Круговерть ».
Учитель объясняет» Элемент Алюминий находится в главной III группе повторяющейся системы хим частей Д.И.Менделеева. В данной нам подгруппе находится ещё четыре элемента B –бор, Ga -галлий, In — индий, Ta -таллий. Посреди частей III группы наибольшее значение имеет алюминий. В обучение (педагогический процесс, в результате которого учащиеся под руководством учителя овладевают знаниями, умениями и навыками) темы «Алюминий и его свойства» нужно начертить технологическую карту алюминия.

Алюминий в природе.
Положение в повторяющейся системе.
Опосля объяснения учителя ученики делятся на 6 групп.
Учащимся разъясняется цель урока.
Раздаются вопросцы представителям групп.
Разъясняется ход урока.
Даётся время для подготовки ответа.
Ученики без помощи других читают текст темы, и они должны заблаговременно принести новейший материал по новейшей теме. Для каждой группы на столе приготовляют бумагу для описания темы, фломастер, клей, цветные бумаги, ножницы, раздаточный материал Даётся время для изготовление ответа.
Вопросец №1. Что нужно знать при исследовании алюминий как хим элемент? Опишите по способу «Цветок подсолнухи». При обучении элемента нужно знать нахождение алюминия в природе, положение в повторяющейся системе, физические и химические свойства, внедрения и получения алюминия.
Вопросец №2. Какое положение алюминия в повторяющейся системе? По способу «Цветок подсолнухи».
Вопросец№3. Физические свойства алюминия.
Вопросец№4. Химические свойства алюминия используя способ »Скелет рыбы.»
Вопров№5. Что такое алюминотермия? Напишите уравнение реакции. Применение алюминия используя способ «Кластер».
Вопросец№6. Получение алюминия. Опишите по способу «Круговерть».
Каждой группе даётся вопросец получив вопросец, пишет по одному ответа и передает вопросцы последующей группе. Опосля истечение времени группы учеников начинают презентацию по способе «Круговерть».Ученики сами себя инспектируют во время ответа и сами могут оценивать друг дружку за верный ответ. Ответы на 1 вопросец. Заблаговременно ученики готовят из цветных бумаг лепестки подсолнухи, пишут ответ, клеят
Передают друг дружке, так создаётся цветок подсолнухи.
I . При обучении элемента алюминия нужно знать:
1гр.1ответ нахождение алюминия в природе,
2гр.2ответ положение в повторяющейся системе,
3гр.3ответ физические свойства,
4гр.4ответ химические свойства,
5гр.5ответ алюминотермия, внедрения алюминия
6гр.6 ответ получение алюминия.
II . Какое положение хим элемента алюминия в повторяющейся системе?
Любая группа пишет по два ответа:
1гр. хим символ Al 3 периуд.
2гр.3 ряд сплав.
3гр 3валнтност пр№13
4гр атомный вес27 Al 2 O 3 кислород соед
5гр водородн соед — атом.строен. +) 2 ) 6)3
6 гр p =+13 e = — 13 n = 14, эл . конф .1S 2 2S 2 2P 6 3S 2 3p 1
III . Физические свойства алюминия:
1гр. имеет серебристо-белый цвет,
2гр. весьма мягенький
3гр проводит теплоту,
5гр. сравнимо легкоплавкий, плавится 659 0 С
6гр. Бурлит при 1800 0 С
IV . Химические свойства алюминия по способу «Скелет рыбы»
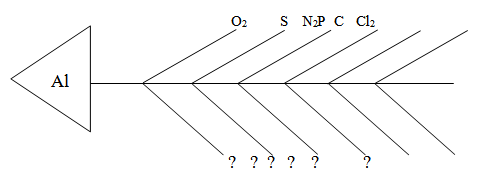
4 Al + 3O 2 =2Al 2 O 3 2Al +N 2 =2AlN Al + P = AlP
2Al +S =Al 2 S 3 4Al + 3C = Al 4 C 3 2Al + Cl 2 =2AlCl 3
V . Применение алюминия по способу» Кластер»
1гр. в машиностроении
2гр. авто и тракторостроении
4гр. в строительстве
5гр. в самолётостроении
6гр. в производстве продуктов народного употребления.
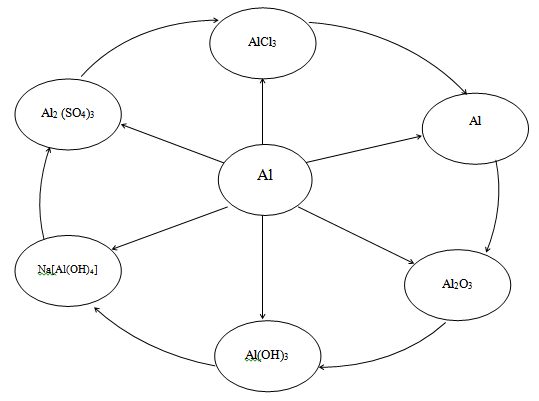
VI . Получение алюминия по способу «Круговерт».
Al → Al 2 O 3 → Al(OH) 3 → Na[Al(OH) 4 ] → Al 2 (SO 4 ) 3 → AlCl 3 → Al
Опосля ответа всей группы, учитель делает выводы, если нет полного ответа, учитель сам объясняет ученикам и ставит оценки. Оценки : за домашнее задание, ответ за пройденные темы, ответ по новейшей теме. Даётся домашнее задание: прочесть, решить задачку, просмотреть что-то новое для новейшей темы.
При опросе учеников по пройденной теме либо в процессе исследование новейшей темы, мы советуем применять несколько типов педагогических, интерактивных, инноваторских способов. Используя приятные пособия, схемы, чертежи, лабораторные опыты, также демо опыты делают лучше последующие возможности учеников, к примеру, свободно мыслит, созодать нужные выводы, работать персонально и в группах.
When questioning pupil on previous subject or during the study of the new subject we recommend using several types of pedagogical, interactive, innovative methods. Using the visual aids, schemes, drawings, experimental problems, as well as demonstration experiments will improve pupils the following skills such as thinking independently, doing necessary conclusions, working individually and in groups.
Ишмухамедов Р ., Абдукадыров А., Пардаев А. Инноваторские технологии в образовании. – Ташкент: 2008.
Ходиев Б., Голиш Л. Организация способов и приёмов в процессе самостоятельной учёбы. – Ташкент: 2010.
Похожие статьи
Исследование темы “Углерод и его свойства” с помощью.
повторяющаяся система, III, получение алюминия, свойство, ответ, группа, алюминий, раздаточный материал, аналогическое мышление, домашнее задание.
Реализация межпредметных связей в процессе обучения химии.
Смеси – дисперсные системы – лакокрасочные материалы – полимерные смолы.
Проекты на тему «Алюминий на кухне: страшный неприятель либо верный ассистент?», «Воздействие алюминия на
Юный ученый. Считаем, что при исследовании химии задания с выбором ответа полностью.
Исследование заморочек обработки алюминия | Статья в журнальчике.
Зависимо от состава и состояния либо прочности при обработке резанием алюминия выделяют три группы: 1 — нестареющие деформируемые сплавы; 2
Дюралюминий Д16 относится к дюралевым сплавам системы Al-Сu-Mg, легируемым марганцем.
Формирование пористых слоев на базе оксида алюминия для.
Оплата (выдача денег по какому-нибудь обязательству) и скидки. Вопросец — ответ. Отзывы и защиты наших создателей.
Мошников В.А., Гамарц А.Е., Чеснокова Д.Б., Мараева Е.В. Получение и свойства
Нанопористые материалы, такие как пористый кремний, оксид алюминия и остальные оксиды металлов, интенсивно.
Анализ процесса литья алюминия в кристаллизаторе.
Вопросец — ответ. Отзывы и защиты наших создателей.
Библиографическое описание: Одинцов М. В. Анализ процесса литья алюминия в кристаллизаторе с
Приобретенное в итоге расчетов значение толщины потом отображается и временами обновляется на мониторе.
Воздействие стратегий критичного мышления на увеличение.
[1]Для удачного выполнения заданий по химии нужно не только лишь познание фактического материала, но и умение логически мыслить
– возможность применять модель обучения и систему действенных методик, которые содействуют развитию критичного мышления и.
Интерактивные способы преподавания химии в современной школе
Получение нужной инфы. Инструктаж учащихся для выполнения задания. Презентация домашнего задания. Ознакомление с раздаточным материалом. 4 шаг.
Внедрение новейших технологий в системе обучения является нужным условием.
Конкурсные задачки по химии на закон электролиза Фарадея
Потому этот материал предназначен для широкого круга учащихся—от троечников до медалистов.
В смесях солей металлов первой группы восстанавливается лишь водород.
Разыскиваемый сплав — алюминий. Ответ:АlСl3.






























